Artikel Kimia SMA Kelas X. Dalam sejarah manusia ilmu pengetahuan akan terus berkembang mengikuti perjalanan waktu, begitu juga dengan teori-teori kimia seperti teori tentang atom, seperti pada tulisan sebelumnya "Artikel IPA" telah menyajikan 2 teori atom yaitu Teori Atom Dalton yang selanjutnya dibantah dan muncullah teori atom baru yang dikenal dengan Teori Atom Thomson namun pada tahun 1911 seorang ilmuwan menyangkal kebenaran kedua teori atom tersebut, adalah Rutherford mengatakan bahwa merupakan bermuatan positif dan disekelilingnya terdapat elektron yang bermuatan negatif layaknya roti kismis, yang selanjutnya teori ini dikenal dengan Teori Atom Ritherford.
Pengertian Atom Rutherford
Teori Atom rutherford mengatakan bahwa Atom mempunyai inti yang merupakan pusat massa yang kemudian dinamakan dengan istilah nukleus, dengan dikelilingi awan elektron yang bermuatan negatif.
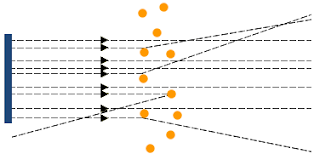
Teori Atom Rutherford didasarkan dari beberapa eksperimen yaitu dengan melakukan penembakan inti atom lempengan emas dengan partikel alfa yang selanjutnya dikenal dengan percobaan Gieger-Marsden. pada saat itu Rutherford menyusun desain rancangan percobaan penembakan atom lempengan emas oleh partikel alfa yang dipancarkan oleh unsur radioaktif. Dan ternyata sinar radioaktif tersebut ada yang dipantulkan, dibelokkan dan diteruskan. perhatikan gambar dibawah ini:
pada gambar di atas Rutherford menjelaskan bahwa jika partikel sinar alfa mengenai inti atom maka akan terjadi tumbukan yang mengakibatkan pembelokkan atau pemantulan partikel alfa, hal tersebut diakibatkan karena massa dan muatan atom terpusat pada inti (nukleus). Rutherford menyatakan bahwa muatan inti atom sebanding dengan massa atom dalam SMA (satuan Massa Atom). partikel alfa yang mengenai awan elektron tidak dibelokkan maupun dipantulkan.
Dalil Rutherford
dari Penjabarab di atas maka model atom Rutherford dapat disimpulkan sebagai berikut:
Kelemahan Teori Atm Rutherford
Pengertian Atom Rutherford
Teori Atom rutherford mengatakan bahwa Atom mempunyai inti yang merupakan pusat massa yang kemudian dinamakan dengan istilah nukleus, dengan dikelilingi awan elektron yang bermuatan negatif.
Teori Atom Rutherford didasarkan dari beberapa eksperimen yaitu dengan melakukan penembakan inti atom lempengan emas dengan partikel alfa yang selanjutnya dikenal dengan percobaan Gieger-Marsden. pada saat itu Rutherford menyusun desain rancangan percobaan penembakan atom lempengan emas oleh partikel alfa yang dipancarkan oleh unsur radioaktif. Dan ternyata sinar radioaktif tersebut ada yang dipantulkan, dibelokkan dan diteruskan. perhatikan gambar dibawah ini:
pada gambar di atas Rutherford menjelaskan bahwa jika partikel sinar alfa mengenai inti atom maka akan terjadi tumbukan yang mengakibatkan pembelokkan atau pemantulan partikel alfa, hal tersebut diakibatkan karena massa dan muatan atom terpusat pada inti (nukleus). Rutherford menyatakan bahwa muatan inti atom sebanding dengan massa atom dalam SMA (satuan Massa Atom). partikel alfa yang mengenai awan elektron tidak dibelokkan maupun dipantulkan.
Dalil Rutherford
dari Penjabarab di atas maka model atom Rutherford dapat disimpulkan sebagai berikut:
- Sebagaian besar volume atom merupakan ruangan hampa
- Massa atom terpusat di inti atom
- Muatan atom terkonsentrasi pada pusat atom dengan volume yang sangat kecil, kelipatan muatan ini sebanding dengan massa atom
- Awan elektron tidak memperngaruhi penyebaran partikel alfa
Kelemahan Teori Atm Rutherford
- Menurut hukum fisika klasik, elektron yang bergerak mengelilingi inti memancarkan energi dalam bentuk gelombang elektromagnetik. Akibatnya, lama-kelamaan elektron itu akan kehabisan energi dan akhirnya menempel pada inti.
- Model Atom Rutherford ini belum mampu menjelaskan dimana letak elektron dan cara rotasinya terhadap inti atom
- Elektron memancarkan energi ketika bergerak, sehingga energi aom menjadi tidak stabil.
- Tidak dapat menjelaskan spektrum garis pada atom hidrogen (H)

No comments:
Post a Comment